微流控芯片細胞捕獲分離方法概述
細胞捕獲分離是指把在液體中的多種混合細胞通過物理學、化學、生物學等手段,從液體中分離出一種或幾種細胞的過程。細胞捕獲分離作為生物學、醫療診斷、毒理監測等方面的重要實驗內容,一直是實驗室研究的一個熱點。細胞捕獲分離后可用于細胞計數、細胞培養、細胞免疫及細胞周期狀態觀測等后續實驗,是一種必不可少的實驗手段。
在很多時候,細胞計數與細胞捕獲分離的區分并不明確,細胞計數常會用到細胞捕獲分離作為前置手段,但很多細胞計數的手段和方法并不能適用于細胞捕獲分離。細胞計數只要求得到規定樣品中目的細胞數,可以通過破壞細胞結構或在混合樣品中直接針對特定細胞的電容、電阻進行測定,并不一定要對目的細胞進行捕獲分離。而細胞分離則需要從樣本中有針對性地分離出所需細胞,往往對收集后的細胞還有較高的要求,需要保持細胞原有的形態,甚至一些實驗還要求細胞生長狀態正常,以便對其進一步地觀察和研究。這就大大限制了細胞分離的方法,提高了難度。
細胞計數主要包括白細胞、紅細胞、循環腫瘤細胞等細胞計數。白細胞計數(包括CD3+/CD4+/CD8+T淋巴細胞計數等)常用于檢測炎癥反應、人體免疫缺陷病毒(humanimmunodeficiencyvirus,HIV)感染、寄生蟲感染等與人體免疫相關的疾病,其數值的升高和降低都會對體內免疫系統產生巨大影響,常作為人體健康狀況的重要參照指標。紅細胞計數作為血常規的一個檢測指標,常用于貧血、白血病等病癥的檢測。另外,近年來針對癌癥相關研究的不斷突破,計數檢測外周血中痕量循環腫瘤細胞(circulatingtumorcells,CTCs)也成為了癌癥診斷的一個生物標志物,可以檢測癌細胞的遷移。除細胞計數外,生物科學和醫療診斷的前期實驗也常需要細胞分離技術,為后續如藥物刺激、細胞培養等實驗研究做準備。
目前細胞分離的手段多種多樣,如流式細胞分離、蔗糖密度梯度離心細胞分離、介電電泳分離[7]等,在本文中就不做贅述。本文具體介紹的是這幾年迅速發展起來的微流控平臺的細胞捕獲分離技術。
1微流控芯片發展介紹
微流控芯片技術是指把生物學、化學等實驗的基本操作過程集成到一塊芯片上,其芯片內部結構中至少有一維為微米甚至納米尺度規格結構,可以自動完成實驗及分析的全過程。由于微流控芯片具有集成性、高通量、檢測快速、操作便利、所需樣本量少、低耗能、低成本等優點,近年來其在藥物篩選、環境檢測、司法檢測、臨床診斷和生物醫藥研究等眾多科研與生活領域擁有越來越廣闊的應用前景。
微流控芯片主要是在微米尺度下操控的流通技術,但是與傳統的流通技術相比,微流控系統一個最重要特征就是微型化,而且同時要考慮便于攜帶和檢測,微流控芯片在精細結構上要比流體技術更為復雜。微流控芯片的主要構成部分根據不同的實驗目的與需求會有很大的不同,有關細胞捕獲分離的微流控芯片,大多包括進樣管路、細胞捕獲或分離區域、廢液收集區和反應檢測區幾部分(圖1)。進樣管路和廢液收集區域屬于基本構造,大部分微流控芯片的構造也基本相近,并非是影響實驗和微流控芯片的關鍵部分。而微流控芯片主要的功能區在于捕獲分離區和反應檢測區,這兩部分也是不同微流控芯片的關鍵和特色區域。在捕獲分離區主要是根據細胞的大小形態等物理特性對目的細胞進行分離攔截或特異性結合捕獲目的細胞。在反應檢測區域,應用光學傳感器是一類較為廣泛的檢測方法,此外還有表面等離子體共振(surfaceplasmonresonance,SPR)、波導管、熒光、單細胞表征分析和化學發光等檢測方法。
2微流控芯片細胞捕獲分離主要方法
本文主要歸類分析不同實驗目的的微流控芯片在細胞捕獲分離區域的不同構造原理,比較不同捕獲分離方式的特點及優劣性。常見的微流控芯片細胞捕獲分離方法有磁珠捕獲分離、微矩陣捕獲、微液滴分選、聲波分離等方法,按最終捕獲分離細胞的狀態可分為免疫捕獲細胞分離和無標簽細胞分離兩種(表1)。
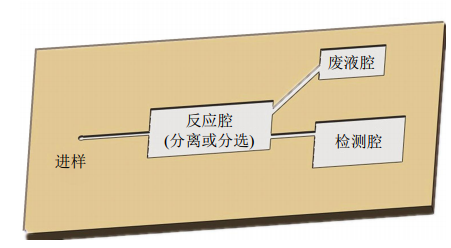
Fig.1Thestructurediagramofmicrofluidicchips圖1微流控芯片結構示意圖
2.1免疫捕獲細胞分離
免疫捕獲細胞分離的方法目前在生物學領域應用較廣,該類方法主要根據抗體可以特異性結合目的細胞表面抗原,借此分離目的細胞。其優點在于可以特異性地捕獲目的細胞,所得到的細胞純度較高,也是目前普遍使用的細胞捕獲、計數方法。其缺點在于捕獲分離后的細胞表面多帶有捕獲抗體甚至其他標記熒光、微珠等,不利于后續細胞的培養和狀態性質的進一步觀察研究,多用于細胞計數等檢測手段。
2.1.1抗體特異性細胞捕獲
抗體特異性細胞捕獲是生物學上最常用到的捕獲方法,通過細胞表面的抗原與特異性抗體結合,固定抗體以捕獲細胞。對于抗體特異性捕獲細胞,抗體相對于捕獲細胞靶點的親和性是十分重要的。但是由于一個完整細胞要比抗原、抗體大很多,用一個或幾個抗原-抗體相結合很難抓住一個細胞,所以在抗體特異性細胞捕獲中,往往需要控制流速、采用多個結合點多次攔截捕獲細胞的方法,加大細胞被捕獲的幾率(圖2a)。
Bio-Acoustic-MEMSinMedicine(BAMM)實驗室及其合作單位集成微流控芯片,采用無透鏡成像即時檢驗(point-of-caretesting,POCT)方式進行CD4+T淋巴細胞計數,在微流控通道內固定CD4抗體,控制進樣流速在合適范圍,捕獲細胞為下一步無透鏡成像做準備。這種方法對于CD4+T淋巴細胞的捕獲效率在(70.2依6.5)%、特異性為(88.5依5.4)%。在微流控芯片上直接包被抗體去捕獲細胞,芯片制作和加工相對簡單,細胞捕獲的特異性也很高,但全血樣品需要稀釋處理,而且樣品和洗液的進樣速度對于捕獲效率有較大影響,這并不利于全血中CD4+T淋巴細胞的精確定量。
Table1Comparisonofthemethodsemployedinmicrofluidicchipstocaptureandseparatecells表1微流控芯片細胞捕獲分離方法比較

2.1.2磁珠細胞分離
磁珠標記抗體特異性結合目的細胞,再通過磁力分離目的細胞,是實驗中經常會用到的方法。磁珠捕獲細胞分離的方法應用范圍廣泛,只要有可以與目的細胞特異性結合的抗體就可以有針對性地捕獲細胞。而且大多數情況下,磁珠捕獲細胞的特異性很高,但是磁珠的大小、抗體對細胞表面抗原的親和性強弱以及細胞所在緩沖液的黏稠度等因素對于目的細胞捕獲效率影響很大,尤其在細胞環境較復雜(如全血條件)時磁珠的捕獲效率較低。
在Glynn等設計的微流控芯片中,用巧妙的方法解決了磁珠捕獲中一個很大的問題——磁珠與樣品難以混合均勻,尤其是黏稠度較高的樣品(如全血),從而影響磁珠與目的細胞的結合效率。他們的芯片設計有兩個內腔,可以通過來回按壓兩個腔室促進樣品與磁珠混合,之后收集分離目的細胞(圖2b)。這個芯片優勢在于不需要電動機等設備,只需要用手指按壓彈性膜就可以達到全血與磁珠的混合效果,他們用這種方法可以高效捕獲全血中CD4+T細胞,捕獲率高達(93.0依3.3)%。
2.1.3表面張力不相容過濾篩選/非混相屏障細胞篩選
表面張力不相容過濾篩選(IFAST)是通過微尺寸物理現象建立的不相容液體流向壁壘(非混相屏障),不相容液相界面間具有較高的能量,形成一道屏障,可以阻止不想要的細胞或其他雜質通過。Scott及其實驗室利用IFAST方法從混合型的基質細胞、熒光、全血中特異性分離乳腺癌細胞,效率大約為70%,純度>80%,還可以通過多級非混相屏障提高分離純度。該方法符合微流控芯片操作特點,成本低廉、操作簡便、反應快速,而且不需要洗去多余成分步驟,降低了洗滌步驟帶來的不確定性,但利用IFAST方法分離,在進樣腔內需要事先用磁珠捕獲目的細胞,再利用磁鐵把目的細胞從非混相腔吸出到收集腔(圖2c),細胞結合磁珠可能對細胞的后續操作會有影響,如果可以尋找方法從非混相腔中直接獲得目的細胞,利用范圍會更廣。

Fig.2Structurediagramsoftheimmunocapturecell鄄separationmicrofluidicchips圖2免疫捕獲細胞分離芯片結構示意圖(a)抗體特異性細胞捕獲示意圖。(b)磁珠細胞分離芯片示意圖。(c)表面張力不相容過濾篩選芯片示意圖。
2.2無標簽細胞分離方法
無標簽細胞分離大多采用物理學中流體力學、慣性力等方法,根據細胞自身物理形態或利用黏附分子等對細胞表面施加瞬間作用力,使不同細胞在微流控通道所受外力不同,從而達到細胞分離的目的。無標簽細胞分離方法優勢在于分離出的細胞表面無任何其他修飾,可以繼續培養及觀察細胞理化性質。但無標簽細胞分離由于是通過物理分離法,得到目的細胞常常純度不高,其中混雜有其他雜質或非目的細胞。
2.2.1小孔徑攔截細胞分離
近幾年來,交叉學科的研究應用越來越被人們所重視。由于不同細胞在大小、形態、剛性、透光度等方面都會有所差別,借由物理方法可以對細胞進行分離。目前所用物理方法分離細胞的手段也越來越多樣化,最基本的是根據細胞大小和外形差異,直接進行分離。
McDevitt等利用徑跡蝕刻聚碳酸酯膜嵌入式捕獲細胞的方法,在酯膜上通過重離子加速器對膜進行射擊,再用化學試劑清洗來控制孔徑大小,利用雙層酯膜孔徑大小對全血中細胞進行吸附分離。這種方法利用膜上的孔徑攔截不能通過的細胞(白細胞等),而血漿、紅細胞、血小板等小體積顆粒可以通過,由此把目的細胞從全血中分離(圖3a)。他們選用此方法攔截全血中的CD4+T細胞后,在整合的納米生物芯片系統中通過半導體量子點對全血中的CD4+T細胞進行計數[21-23]。這種方法的捕獲效率能達到95%,但是特異性不高,會有很多其他細胞也吸附攔截在膜上,所以后續需要用特異性抗體識別標記后再計數。
2.2.2非對稱流系統細胞分離
非對稱流分離系統(asymmetricalflowfield-flowfractionation,AFF)是通過不對稱分子模式的瞬間作用力,在物理方面廣泛運用的側向位移,同時延長了分子特異性標簽的長度,可以有效地從全血的持續液流中分離出白細胞。相對于垂直作用力的細胞連續分離方式(如電泳法、聲波法、引力作用、慣性作用、外磁場力等),非對稱流分離系統通過黏附分子對細胞施加瞬間不對稱作用力,偏轉流動過程中細胞的垂直方向作用力,不需要捕獲而達到細胞分離效果。這種微流控芯片的滾動附著力是通過在微流控通道中修飾一層黏附分子P選擇素,施力作用于淋巴細胞表達的P選擇素糖蛋白配體1(PSGL-1),使淋巴細胞滾動方向發生偏移(圖3b)。這種微流控芯片可以分離復雜環境中的目的細胞,細胞不需要標記標簽,避免不可逆的細胞捕獲,分離后細胞有較高的存活率及功能完整性。
2.2.3聲波細胞分離
聲波細胞分離是在芯片微通道兩側,通過聲波對細胞施加外力,由于細胞的大小、質量、密度等物理性質不同,所受聲波力不同,使細胞在微通道中偏轉角度改變,不同種細胞會流成幾股液流,在不同方向收集,以達到細胞分離目的。為了區分一些物理狀態相似細胞,也可以特異性標記一些微珠在目的細胞表面,以此改變細胞的物理特性,而更好地分離出目的細胞。
Lenshof和他的同事[26]通過聲波方法,利用磁珠或熒光激活分離條件,以達到分離或去除外周血祖細胞(peripheralbloodprogenitorcell,PBPC)中特異性細胞的目的。這種方法是特異性抗體標記磁珠后與目的細胞結合,目的細胞結合磁珠后大小質量等物理特征有別于未標記細胞,再通過聲波分離出目的細胞。單純用免疫磁珠分離得到細胞純度是(96依3)%,回收率是56%;結合聲波方法的細胞分離純度是(87依12)%,回收率是65%。從Lenshof的實驗結果可以看出,只通過磁珠捕獲細胞后分離的純度較高,但捕獲效率較低,結合聲波輔助分離可以提高捕獲效率,但是對細胞純度會有些許影響。另外,Lenshof實驗中用到的磁珠標記抗體捕獲細胞后,可通過蛋白酶把與磁珠相連的細胞分開,細胞可進一步培養。
在2009年,美國賓州州立大學的科學家研制出一種以聲音作為鑷子的系統,其小至可以放置在芯片上,對單個細胞或納米大小的顆粒進行操控[27].但是由于所需芯片無法批量生產,實際運用難度較大,不利于常規實驗操作。之后麻省理工、賓夕法尼亞州立大學和CarnegieMellon大學的研究人員,發明了一種以聲波為基礎的新型細胞分離技術。通過聲波對細胞外加力場,依據細胞的可壓縮性、細胞內質密度和細胞所在液態環境對細胞進行分離。而相對于其他聲波分離細胞方法,Li等[29]采用斜角表面聲波技術(taSSAW),提高了聲波分離的精確性和準確度(圖3c)。其可應用于外周血中分離CD4+T細胞、從白細胞(whitebloodcells,WBCs)中分離檢測CTCs細胞,且具有很高的靈敏性,能從中分離出比例很少的細胞。這類聲波細胞分離的優勢在于不需要對細胞進行人工標記或施加較強的機械外力一類有可能對細胞造成損傷的作用力。聲波是十分溫和的,對細胞的干擾很小,有利于把分離出來的細胞繼續培養或做細胞狀態觀測。目前這種技術已應用于CTCs檢測,可以在癌癥患者的血液里檢測到極為罕見的腫瘤細胞,有助于醫生們判斷腫瘤是否會發生擴散。
2.2.4微液滴細胞分離/熒光激活細胞分選
流式細胞術是細胞計數、分選及性質分析中常用到的手段,微液滴細胞分離所用原理與其類似,但簡化了流式細胞儀的復雜構造。微液滴細胞分選整合了熒光激活細胞分選(fluorescence-activatedcellsorting,FACS)[30]和微液滴芯片技術,從單向微流控芯片技術改為T型結構或流動匯聚型結構,樣品被鞘液包裹形成小液滴,目的細胞標識熒光染料后通過檢測器,激光激活染料熒光再利用光信號收集所要的目的細胞。微液滴細胞分離的精確度和純度都較其他微流控芯片方法更好,但芯片所需配套設備復雜,而且并不適合如全血等復雜環境下的細胞分離。
Mazutis實驗室利用這種方法制作了微液滴單細胞分析分選芯片,用于分選小鼠免疫后的單克隆細胞。其主要通過液滴包裹單個單克隆細胞、熒光探針和包被鼠抗IgG抗體的玻璃微珠,在單克隆細胞分泌抗體后抗體可與微珠結合,熒光探針再特異性結合細胞分泌抗體,讓熒光聚集在微珠表面,通過激光激發分選分泌所需抗體的單克隆細胞(圖3d)。這種方法極大縮短了篩選單克隆抗體的時間,分選少于100萬個細胞只需要2~6h,而整個單克隆篩選過程,包括芯片準備和細胞培養也只需要5~7天。
2.2.5多路復用螺旋微流控芯片細胞分離
螺旋微流控芯片分離細胞是利用曲線微通道中迪恩旋渦流動力原理,較大的CTCs在通道中的慣性上升力與內壁作用力相抵消在螺旋通道內壁流動,而血液中其他較小的物質則靠近外壁一側流動(圖3e),可以借此利用迪恩渦心力實現CTCs從全血中的分離。
Han及其工作團隊通過設計這種微流控芯片分離富集全血中CTCs,首先需要對全血樣本進行處理,離心分離血清后加裂解液裂解紅細胞,下層為有核細胞,再通過多路復用螺旋微流控芯片分離WBCs和CTCs,收集CTCs后可用于細胞培養、免疫熒光染色、單細胞分析等各種檢測。該芯片分離CTCs的效率較高,幾乎能收集全部CTCs,但其中會混雜有少量WBCs,細胞計數需要后續熒光染色、原位雜交等輔助手段。螺旋微流控芯片分離細胞的優勢在于構造簡單、成本低廉、可以高效分離出外周血中的CTCs。但由于該芯片單純靠物理方法分離,主要依靠CTCs的體積遠大于血液中其他細胞[35],對于其他細胞并不適用,而且分離出的CTCs細胞中可能會混有少量WBCs,無法直接計數,還需要后期標記處理。
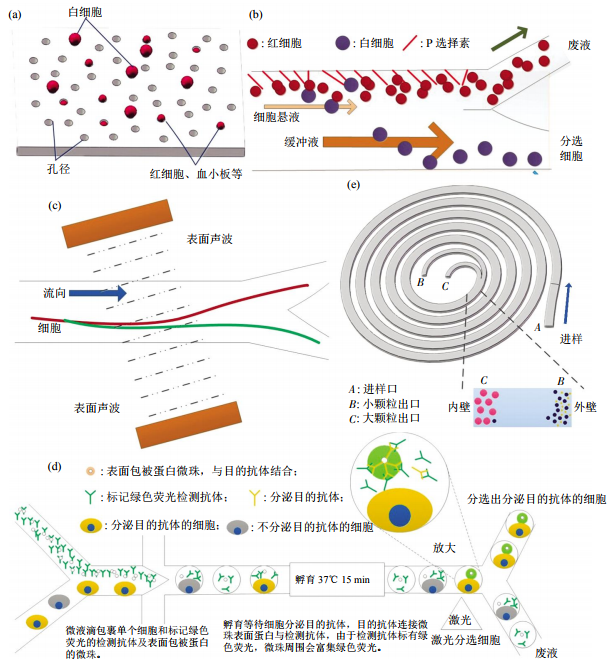
Fig.3Principlesofmicrofluidicdesignforlabel鄄freecellseparation圖3無標簽細胞分離方法芯片結構示意圖(a)小孔徑攔截酯膜電鏡圖。(b)非對稱流系統細胞分離示意圖。(c)斜角表面聲波技術細胞分離。(d)微液滴細胞分選。(e)多路復用螺旋微流控芯片細胞分離示意圖。
3總結與展望
細胞捕獲分離一直是免疫學、診斷檢測、病理研究等學科經常用到的生物學實驗方法。微流控芯片的主要優勢在于:a。上樣體積小,節約原料、試劑與樣本;b。檢測結果單個周期短,可以實現快速測量,節約時間;c。適用于高通量檢測或宏觀尺度無法實現的實驗操作,具有低成本、高效快速的特點,在細胞分離過程中更易做到微觀操控、精準分析。
在微流控芯片中,通過抗體捕獲、熒光標記等標簽標記目的細胞后,多數情況下會對細胞本身產生一定的影響,大多只能用于捕獲分離后的細胞計數。無標簽細胞分離多數是通過物理方法,利用微流控芯片的流體力學原理,從細胞大小、尺寸等方面實現細胞分離。無標簽細胞分離優勢在于分離后的細胞既可用于細胞計數,也可用于細胞理化性質觀察、細胞增殖培養等后續實驗,也是目前細胞分離方法的主要發展方向,但相對于標簽捕獲分離的方法,在純度和特異性上還需要提高。今后微流控芯片在細胞捕獲方面可能更傾向于非標簽方式的捕獲分離,結合物理學與生物學的方法,根據所做實驗的需要,在捕獲效率與純度方面更好協調,高效方便快捷地實現細胞分離的目的。
用于細胞捕獲分離的微流控芯片需根據實驗要求選擇合適材料,如果要進一步培養觀察分離出的細胞,還要確定細胞所在芯片環境是否無菌無毒,是否利于細胞存活生長。微流控芯片材料一般有聚二甲基硅氧烷(polydimethylsiloxane,PDMS)、聚甲基丙烯酸甲酯(polymethylmethacrylate,PMMA)、聚苯乙烯(polystyrene,PS)、玻璃、硅片等。近年來微流控芯片制作比較普遍用到的主要是高分子聚合物材料,其中PDMS應用最為廣泛,尤其在細胞捕獲分離實驗中,PDMS具有較好的生物相容性和一定的透氣性,更有利于實驗中細胞的生長存活及性質分析,但芯片微結構易變形,所以較難應用于商業化大批量生產,而更適用于科研過程中芯片結構及實驗效果摸索。PMMA隨著材料及切割技術的發展越來越普及,在微流控芯片的實驗室發展過程中逐漸得到了廣泛應用。相信隨著微流控芯片技術和材料科學的不斷進步,更多適用于實驗要求的材料也會不斷為芯片的制作及商業化生產提供強有力的推動,促進微流控芯片技術更快更好地發展。
微流控芯片目前的發展策略主要有兩個方向:一類是利用微流控芯片高通量、上樣量小等優勢,在科研過程中使用,解決一些在宏觀層面不易達成的實驗問題,這類芯片并不一定要求最終結果直接在芯片中顯示出來,而是作為一個高精密度的反應容器,最后可利用實驗室內的其他儀器配合實驗,分析結果。另一類是以商品形式面向普通群眾為主要目的芯片,這類芯片往往需要有高度整合性,同時配備微型化的檢測及數據處理裝置,具有可手持診斷、價格適中、方便操作等優點,使用者只需做簡單加樣就可由儀器經過暗箱處理后直接得到最終結果,體現了微流控芯片小型、簡便、快速測定的優勢。微流控芯片在細胞捕獲分離方面,目前主要集中于實驗室層面,配合其他儀器使用,而后一類高度集成的微流控芯片還相對較少,且實現難度遠高于前一種形式。但相信隨著微流控技術和構造方法的進一步發展,細胞捕獲分離技術的持續創新,基于微流控芯片的細胞捕獲、分離將在科學研究和臨床診斷中逐漸得到廣泛應用,為提升人類健康水平做出貢獻。
文獻來源生物化學 DOI: 10.16476/j.pibb.2016.0147作者:董盛華,張 晶,葛勝祥(轉載僅供參考學習及傳遞有用信息,版權歸原作者所有,如侵犯權益,請聯系刪除)